- Llombart V, Mansour MR. Therapeutic targeting of "undruggable" MYC. EBioMedicine. 2022 Jan;75:103756. doi: 10.1016/j.ebiom.2021.103756. Epub 2021 Dec 20. PMID: 34942444; PMCID: PMC8713111.
- Llombart Victor, PhD, Identifying therapeutic vulnerabilities of MYC through next generation structure-function, Session 2: Gene regulation EHA 2024-Kongress 28. Congress of the European Hematology Association. Termin. 13.06.2024 - 16.06.2024, Madrid, Spanien.
Vielversprechendes neues Target in der MYC-Hemmstoffentwicklung
MYC gehört zu den vielversprechendsten Zielstrukturen in der Entwicklung von Tumormedikamenten. Die therapeutische Stilllegung führte in unterschiedlichen Modellen zur gewünschten Regression, ohne gesundes Gewebe zu beeinträchtigen.
Eine Dysregulation mit schweren Folgen
Bei den Myc-Onkoproteinen handelt es sich um Transkriptionsfaktoren. Zur Myc-Onkogenfamilie gehören c-Myc, MYCN (n-Myc) und MYCL (l-myc). Sie unterscheiden sich in ihrer Gewebespezifität. So wird N-Myc im Nervengewebe und in der frühen hämatopoetischen Entwicklung exprimiert. Eine Dysregulation von N-Myc liegt beim Neuroblastom, beim Rhabdomyosarkom, beim Medulloblastom, beim Wilms-Tumor und beim Retinoblastom vor. l-Myc wird in der Lunge exprimiert. Vor allem bei kleinzelligen Lungenkarzinomen wird dieses Onkoprotein überexprimiert. Es wird jedoch vermutet, dass eine geringere transformierende Aktivität vorliegt. c-Myc hingegen wird ubiquitär exprimiert. c-Myc spielt eine zentrale Rolle bei der Steuerung der globalen Genexpression und der Regulation der Zellproliferation, Zelldifferenzierung, Zellzyklus, Stoffwechsel sowie der Apoptose.1,2
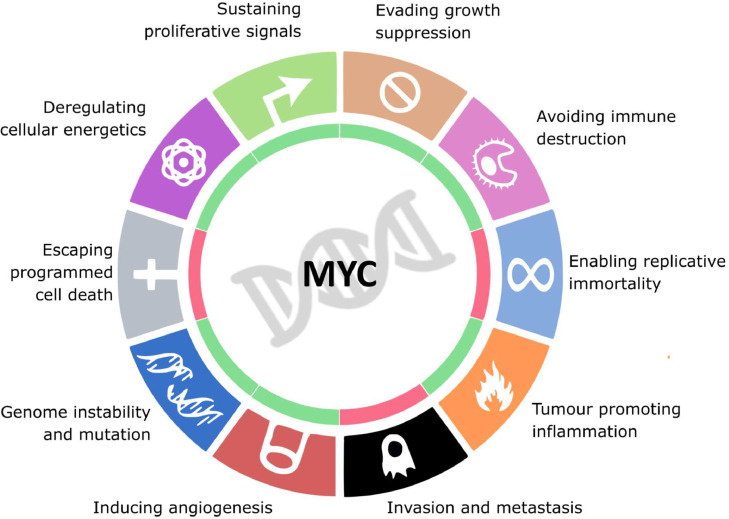
Abbildung 1: Das Gen MYC steuert verschiedene Prozesse, die für die Entstehung und Aufrechterhaltung diverser Krebsarten essentiell sind. Hierzu zählen u.a. die die Umgehung der Immunantwort, die Tumorangiogenese sowie Veränderungen des Zellstoffwechsels.1
Immunescape von Tumoren durch MYC
MYC unterstützt Tumore, dabei der Immunüberwachung zu entkommen. Zu den Immunescape-Mechanismen zählen u.a. die Reduktion der MHCI-Expression, die Hochregulierung von hemmenden Zytokinen und den Immun-Checkpoint-Proteinen wie PD-L1 und CD47. Eine Dysregulation von MYC kommt bei mehr als 70 % Krebsarten vor. Hierzu zählen auch das Burkitt-Lymphom (> 90 %), die T-ALL (80 %), die B-ALL (50 %) sowie die AML (20-40 %).1,2
Strukturell bedingte Hindernisse bei der Entwicklung von MYC-Hemmern
Die strukturgeleitete Entwicklung von in vivo potentiell effizienten MYC-Hemmstoffen musste sich verschiedenen Hindernissen stellen. Das MYC-Protein besitzt funktionelle Domänen, die intrinsisch ungeordnet (N-Terminus) sind und ihm fehlt eine enzymatisch aktive Stelle. Die hochaffine Wechselwirkung zwischen MYC und seinem obligaten Partner MAX stellt ebenso ein Problem bei der Wirkstoffentwicklung dar. Die nukleäre Lokalisierung der Mitglieder der MYC-Familie macht das Ganze nicht leichter. Llombart stellte in seinem Vortrag wichtige MYC-Hemmstoffe vor und informierte das Auditorium über den aktuellen Stand auf diesem Gebiet.2
Gegen den C-Terminus gerichtete MYC-Hemmer erzielen nur suboptimale Ergebnisse
Omomyc (OMO-103) wurde erstmals 1998 entwickelt, um Myc-Störungen zu untersuchen. Es hat bemerkenswerte krebshemmende Eigenschaften bei einer Vielzahl von Tumorarten gezeigt. Hinsichtlich der langen Geschichte von Omomyc (OMO-103) wurde hier erst kürzlich eine mögliche therapeutische Wirkung von gereinigtem Omomyc-Miniprotein beschrieben. In dieser gereinigten Form kann es Zellen durchdringen und als MYC-Hemmstoff seine Wirkung entfalten. Llombart berichtete in seinem Vortrag davon, dass Omomyc (OMO-103) den C-Terminus des MYC-Onkoproteins als Zielstruktur hat. Weitere MYC-Hemmstoffe, die gegen den C-Terminus gerichtet sind sind 10058-F4, I975 und WBC100. Llombart betonte, dass die gegen den C-Terminus gerichteten MYC-Hemmstoffe in vivo nur suboptimale Ergebnisse erzielen konnten.2
Der N-Terminus von MYC ist eine knifflige Zielstruktur
Neben dem C-Terminus stellt jedoch auch der funktionell essentielle N-Terminus eine Zielstruktur für die Entwicklung von MYC-Hemmstoffen dar. Die strukturelle Untersuchung des N-Terminus gestaltete sich Llombart zufolge bisher schwer, da dieser intrinsisch ungeordnet ist. Ihm fehlt dadurch eine feste und damit geordnete dreidimensionale Struktur. Lediglich im Rahmen von Interaktionsprozessen mit anderen Proteinen oder Cofaktoren nimmt der N-Terminus des MYC-Proteins eine geordnete Struktur an, die zur Wirkstoffentwicklung herangezogen werden kann.2
Saure Cluster des N-Terminus von MYC stellen ein neues Target dar
Die Forschungsgruppe um Llombart hat die strukturellen Eigenschaften des N-Terminus von MYC in einem Mausmodell genauer untersucht (DOI: 10.1016/j.ebiom.2021.103756) . Sie konnten herausfinden, dass die sauren Cluster des N-Terminus von MYC essentiell für dessen Funktion sind. Sie steuern die gesamte transkriptionelle Aktivität von MYC. Die sauren Cluster des N-Terminus von MYC sind für eine weitere wichtige Interaktion von Bedeutung und zwar für die zwischen MYC und TRRAP. TRRAP spielt eine zentrale Rolle bei der Aktivierung der MYC-Transkription. Darüber hinaus ist TRRAP u.a. für die p53/TP53-vermittelte Transkriptionsaktivierung erforderlich. Die Interaktion von MYC und TRRAP stellt ein mögliches Target für die Entwicklung zukünftiger Medikamente mit Erfolgsaussicht dar.2